大腸癌肝転移の切除後に対する治療マネージメントについて、日本臨床腫瘍研究グループ (JCOG) が行ったランダム化比較試験 (JCOG0603) の解釈が、ヨミドクターの記事で紹介されました。この記事を読んだ患者さんやそのご家族らは、大腸癌肝転移の切除後に抗がん剤治療は受けない方よいと解釈される方がほとんどではないでしょうか。この記事に書かれている試験解釈について、いろいろ問題があるため、以下に私見を述べます。
その前に、 大腸癌肝転移の補助化学療法の有用性について、国内の既存治療ガイドラインに照らし合わせて論じる際、いつも困惑させられるのは、StageⅢ 対象では、オキサリプラチンを上乗せした化学療法の有用性を示す成熟したエビデンスがあるにもかかわらず、「いわんや StageⅣ の肝転移をや」という点にあるのではないでしょうか。 肝転移切除後の補助化学療法としてオキサリプラチン・ベースの治療は有用か?という問題提起に明確な答えを寄与するものと期待されていた JCOG0603 試験の結果が昨年の米国臨床腫瘍学会 American Society of Clinical Oncology (ASCO)で公表されました。しかし、その結果は主要評価項目が達成した明らかなポジティブ試験であったにもかかわらず、研究グループによる発表内容は非常に不可解なものでした。そのため、結果解釈について国内外で大きな議論が巻き起こることとなり、誰が売り込んだのかはわかりませんが、今回のYomiDr.記事についてはしっかりと批判的吟味 (クリティーク) をしなくてはいけません。
大見出しに「肝切除御の抗がん剤治療は全生存期間を改善せず」とありますが、そもそもこの臨床試験は「無病生存割合」の優越性を検証するための前向き研究であり、全生存期間を改善することを主目的としたデザインではありません。具体的な全生存期間の生存曲線をみると、ハザード比の信頼区間は1をまたいでバラツキが大きく、さらに5年時以内の打ち切りの数が非常に多い、いわゆる 「immature 」な生存曲線です。イベント数も両群ともに非常に少なく、全生存期間の好悪について論じるには時期尚早だといえます。また、全生存期間の足枷になっているのは、明らかに安全性に問題のあった、なかば練習帳のように行われた1回目の第2相試験パートを全体の対象解析に組み込んでしまったことが要因だと考えられます (詳細については後述)。
一方で、「無病生存割合は改善するものの……」の中見出しのあとに、「抗がん剤治療を加えた群では生存期間を延ばすどころか、有意差はないものの、むしろ悪化させる傾向がみられる結果となった。」という記述について、執筆者の恣意が感じられます。
繰り返しますが、この比較試験は、「無病生存割合」を改善したポジティブ試験です。確かに、肝切除後、通り一辺倒に抗がん剤 mFOLFOX6 ×12コースの投与がマストではなく、×6コースでもよいかもしれない、あるいはオキサリプラチンの上乗せまで必要ないかもしれない、補助化学療法自体を避けてもよいかもしれない、のように個別の再発リスクに応じて de-escalation していく戦略が必要だというのが私の考え方ですが、本記事は、明らかに肝切除後の抗がん剤治療は無意味であるかのようなメッセージにみてとれます。
以下、JCOG0603 試験結果について個人的な詳細見解を述べます。
本試験はランダム化Ⅱ/Ⅲ相というデザインが採用されています。大腸癌肝転移を対象とした比較試験を行う際、登録集積は非常に手間がかかり時間も要するため、当初は安全性を確認すすはずであってあ第Ⅱ相部分の登録集団も無駄にしないようにと考えられたわけです。合わせて2回実施された第Ⅱ相パートも第Ⅲ相の解析対象集団に含めるという試験でした。
第Ⅲ相の主要評価項目 プライマリーエンドポイントは 「無病生存期間」 Disease-free survival(DFS)、副次評価項目 セカンダリーエンドポイントは「全生存期間」Overall survival(OS)、有害事象、再発形式となっています。
一方で、比較試験に入る前に行われた第Ⅱ相部分の主要評価項目は術後補助化学療法 mFOLFOX6 ×9 コースの完遂割合でした。JCOG0603 試験は、第Ⅲ相に入る前に第Ⅱ相が2回行われています。
1回目の第Ⅱ相 39例 (1st phaseⅡ) では試験治療である mFOLFOX6 によって、重篤な好中球減少の発現が目立ち (CTCAE Grade3/Garde4 ; 32.4%/16.2%)、9コースの完遂割合はわずか36%という結果でした。完遂割合の閾値50%、期待値70%に設定されていた試験デザインであり、プロトコル中止例も多くみられたことから、1st phaseⅡパートは明らかに「失敗 」であり、本来、この時点で JCOG0603 試験は中止になり得たともいえる。
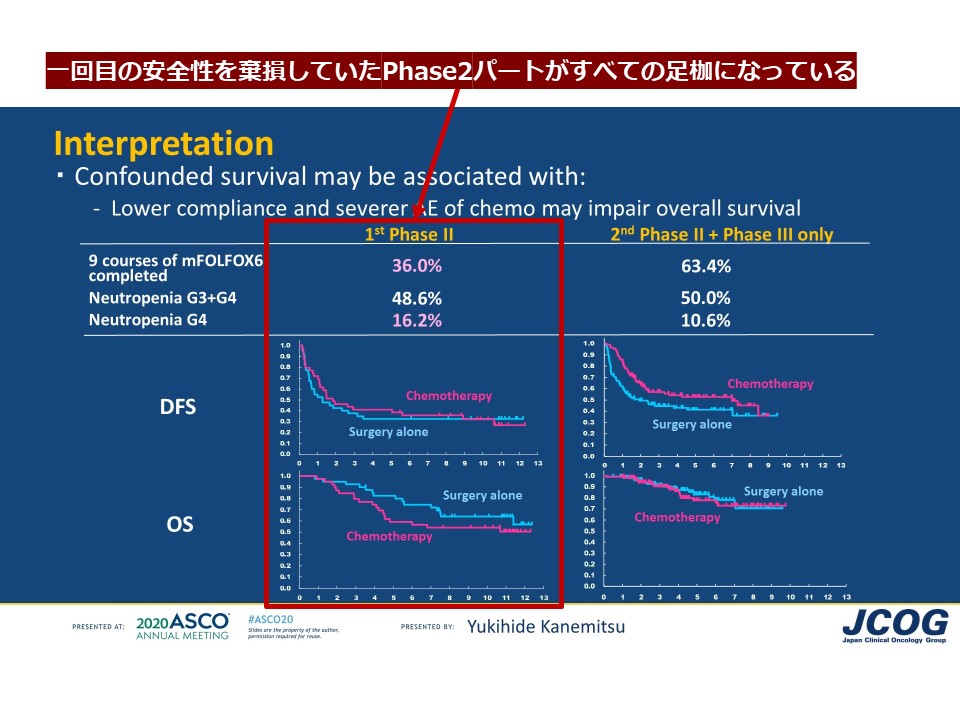
第Ⅱ相は、なによりも試験治療の安全性担保を検討するのが主目的であり、それが叶わなかった 1st phaseⅡ 集団を第Ⅲ相の対象解析に組み入れてしまったことは、とても大きな問題でしょう。その後、プロトコル改訂が行われ、休薬・減量規準について見直しがされた後、2回目の第Ⅱ相 41例 (2nd phaseⅡ) が実施されたわけです。 最初の失敗をふまえてmFOLFOX6治療管理に慣れてきたので、9 コース完遂割合は61%まで改善し、それをふまえて第Ⅲ相パートに入ることとなりました。
第Ⅲ相のみとして登録された mFOLFOX6 群 71例については、9コース完遂割合は65%、第Ⅱ相パートと合わせた mFOLFOX6 群151例のうち、試験治療が完遂できたのが91例(60%)、12コースの完遂割合は67例(44%)と、現在の実臨床レベルから鑑みても、術後補助化学療法としての dose intensity は極めて低いといえます。安全性については、CTCAE Grade3以上の重篤な好中球減少を70例(50%)に認め、安全性においても忍容性の高い試験治療とは言い難い結果でした。
第Ⅲ相パートの主要評価項目 DFS について、mFOLFOX6 群の優越性を検証するデザインとなっており、mFOLFOX6 群の5年 DFS 割合が10~12%の上乗せ効果があると期待され、片側検定α=5%、検出力をほぼ80%以上に保つことを目指したサンプル設定300例となっています。試験開始が2007年ということで、当時はオキサリプラチン併用療法の使用経験に乏しく、現在のような支持療法の進歩もなかった時代でしたから、第Ⅱ相として試験が開始された当初はmFOLFOX6 療法を安全に使いこなすことが難しい試験であったことが想像できます。半ば練習帳のような第Ⅱ相試験部分を第Ⅲ相の解析対象に含めることで、後述するように真理に少なからずの歪みが生じてくるリスクは認識されるべきです。

手術単独群に149例、mFOLFOX6 群に151例が割り付けられた JCOG0603 試験は、2007年3月より患者登録が開始され、2019年1月に登録が完了し、足掛け12年間にわたる長丁場試験でした。2019年12月に開催された効果・安全評価委員会において中間解析の結果が審議され、試験研究者に「試験の早期中止による結果の公表」が勧告されています。
主要評価項目 DFS について、イベント数は手術単独群 88例、mFOLFOX6 群73例、中央値で手術単独群1.5年に対し、mFOLFOX6 群5.1年、5年 DFS 割合は手術単独群37.3%、mFOLFOX6 群50.1%、ハザード比 (96.7% 信頼区間) =0.63 (0.45-0.89)。層別ログランク検定は片側 p=0.002 となり、統計的事項に規定されていた基準 0.0163 を下回っていたため、mFOLFOX6 群の優越性が示されました。
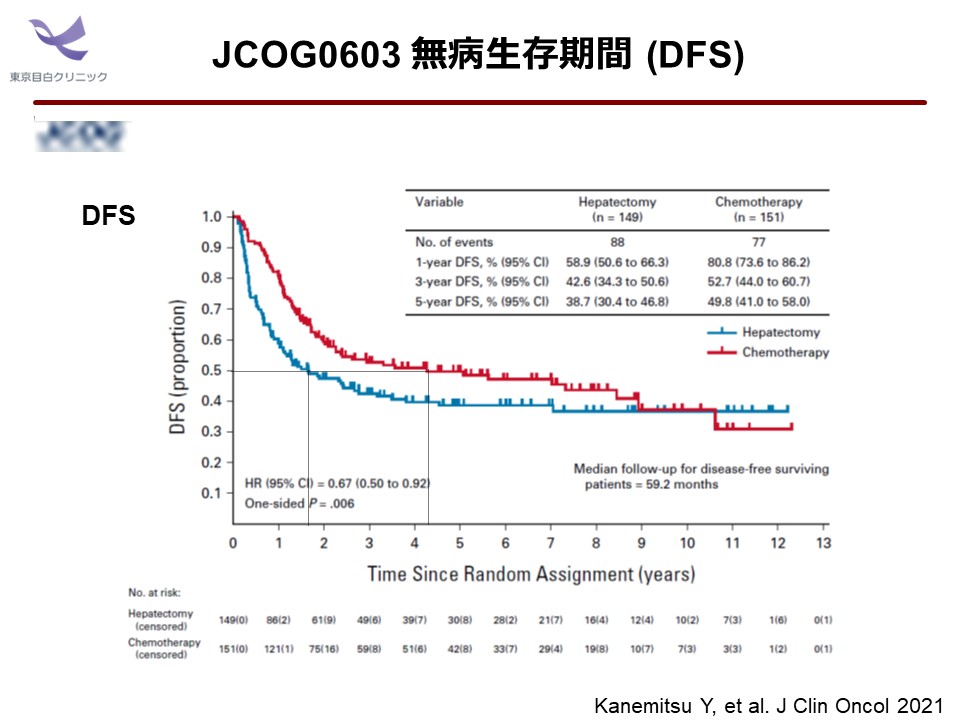
しかしながら、研究グループによるASCOでの発表では、OS に対する “impair” が強く強調され、「Adjuvant FOLFOX is not beneficial to patients after hepatectomy for Liver metastasis from colorectal cancer」と結論づけました。あたかも「無効中止」とされた negative 試験であるかのような扱いには非常に違和感を個人的に抱きました。
試験中止の勧告について、研究グループの総意が試験治療による OS の impair を問題視して「無効中止」とみなしているならば、それは主観的で誤った解釈であると批判しなくてはいけません。なぜならば、副次評価項目 OS の解釈については、試験を中止にした時点において、見かけ上OS の生存曲線が視覚的に上下逆転しているようにみえるだけだからです。早くに試験の蓋を開けてしまったことで、 OS の生存曲線をみるとハザード比(95% 信頼区間) = 1.25 (0.78-2.00) と1をまたいで信頼区間のばらつきが大きく、さらに5年時以内の打ち切り数の多さが非常に目立っているのがわかります。イベント数は、手術単独群 32例(21.5%)、mFOLFOX6 群38例(25.2%)と非常に少なく、OS の群間比較を論じるのは誰の目からみてみ時期尚早だといえます。
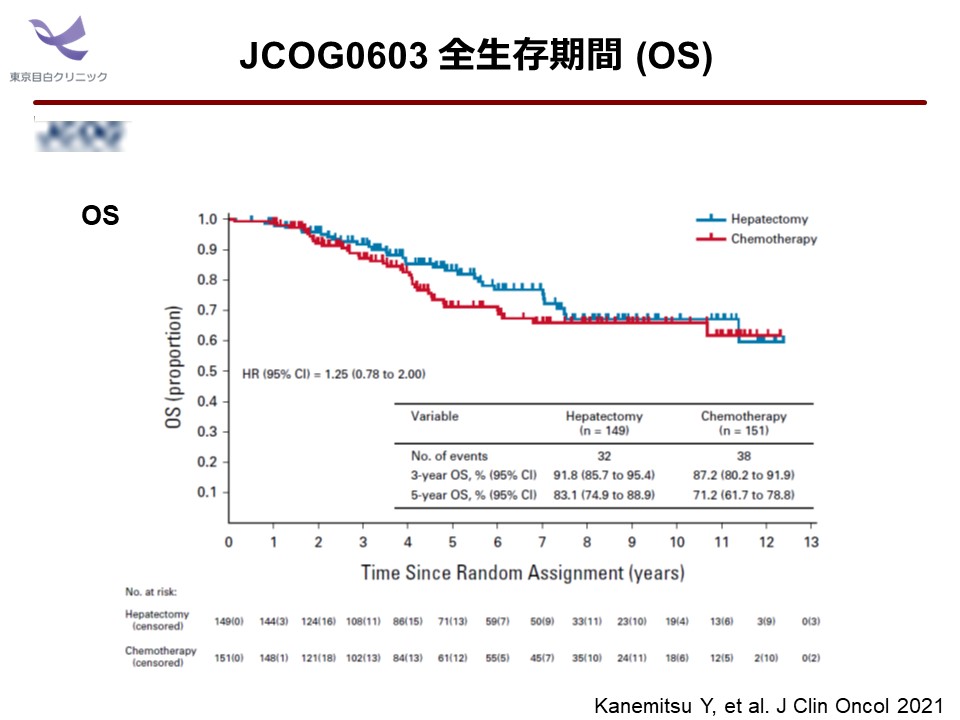
このような、いわゆる 「immature」 な OS 生存曲線には、慎重な解釈が必要であることは明白でしょう。現状、かりに OS の impair について俎上に載せるのであれば、当初手探りで先行していた 1st phaseⅡ が足枷となっているのは明らかです。実際のデータをみると、試験治療として明らかに異質であった 1st phaseⅡ 集団を除外した 2nd phaseⅡ+phaseⅢonly集団の生存解析がより真理に近いと考えられます。
以上より、JCOG0603 試験は試験デザインに問題があるものの、主要評価項目 DFS において、手術単独群に比し mFOLFOX6 群の優越性が検証された立派な positive 試験です。一方で、公表を急いだ OS の見かけ上の差異については、現状では何も言えないため、さらなる長期追跡によってイベント数がある程度揃った mature な時点で再評価をすべきと考えます。
さらに問題点を挙げますと、「Post-relapse survival 」再発後生存期間というトリッキーな概念が強調されています。 Post-relapse survival (PRS) について、再発イベント対象のみに注目した予後を群間比較しているようですが、JCOG0603 試験のプロトコルで定められた評価項目ではありません。また、「OS=DFS+PRS」と定義した場合、OS が immature であるならば、PRS もまた同様にimmature だといえます。再発イベントを覗き見て、条件を変えて後付けで解析をするやり方は、前向き試験においてご法度です。
ところが、研究グループは「Adjuvant mFOLFOX6 reduced post-relapse survival」と結論付けました。肝切除後に mFOLFOX6 を投与すると再発してからの生存期間に不利益を被るから、避けたほうがよい、と示しているかのようなメッセージです。これが、今回のYomiDr.記事にも同様にその内容が反映されています。
しかしながら、これはリスクのみに注視した「確証バイアス」だといえるでしょう。試験全体を漏れなく評価するならば、mFOLFOX6 を投与することで再発を免れている対象の生存期間についても等しく扱うべきである。
一方で、mFOLFOX6 群の PRS が不良なのは当然ともいえます。同じ再発イベントとはいえ、化学療法naïve再発例と化学療法修飾後の再発例は明らかに生物学的には異なるからです。これは、なにも大腸癌肝転移に限った話ではなく他のがん腫にも相当する話です。
そのほかの諸問題についても指摘します。
試験参加登録のタイミングが術後であるため、肝切除 (手術) 自体はプロトコル治療には相当していません。しかし、術後補助化学療法の比較試験の原則は、手術の質の担保が大前提であり、肝切除 (手術) についての評価がASCOの発表では示されていませんでした。肝切除の考え方についても時代的変遷があり、例えば第Ⅱ相パートとして行われていた旧い時期の肝切除について、dose intensity を余儀なく減じたり、長期予後に影響を与える大量肝切除の割合がどれほどであったのかのデータも示されていません。
もう一つ大きな懸念点は倫理的事項にあります。足掛け12年にわたる超ロング試験期間において、対照群を「手術単独」で貫いたことは研究グループの意地がみてとれます。しかしながら、この期間中の大腸癌化学療法の進歩は言わずもがな、大腸癌肝転移に対するエビデンスの蓄積が進み、治療戦略においてはグローバルな視点から一定のコンセンサスも得られるようになった最盛期でもあります。
JCOG0603 試験参加患者にとって、対照群、試験治療群のどちらに割り付けられても不利益を被らないことが大前提だとするならば、特にリンパ節転移を有する「同時性」症例に対して、あるいは2014年のASCOで UFT/LV 試験の positive 結果が公表された以降に手術単独群に割りつけられた症例に対して、利益・不利益についてどの程度の情報提供がされたうえでインフォームドコンセントが成立していたのでしょうか。研究のために、フェアな情報を提供しないで誘導しているやり方であったならば、非常にまずいのでないでしょうか。
最後に、JCOG0603 試験は、切除可能な大腸癌肝転移を対象としたランダム化比較試験の難しさをあらためて教えてくれた試験でもあります。理由は、治療マネージメントにおいて、大腸外科医、肝臓外科医、腫瘍内科医の等しい相互連携と治療の質の担保があってこそ成り立つ疾患対象だからです。ベクトルを同一とした連携に歪みが生じると、結果解釈の歪みにも繋がることを思い知らされた試験でもありました。今後、真の multidisciplinary team (MDT)マネージメントを実践した質の高い新たなエビデンスの創出が望まれる一方、YomiDr.記事だから、がんセンターからの研究発表だからと、解釈を鵜呑みにしない批判的吟味 (クリティーク) の必要性も痛感しました。


コメント